Nukleární magnetická rezonance
Nukleární magnetická rezonance (NMR) je fyzikální jev, který je mimo jiné základem zobrazovací metody MRI (magnetic resonance imaging). Při NMR je vzorek (nebo pacient) umístěn do silného magnetického pole v jehož přítomnosti se některá atomová jádra (například vodík) chovají jako drobné magnety. Krátké radiofrekvenční pulzy s vhodnou frekvencí působí na tato jádra a mění jejich orientaci. Jádra na tyto pulzy reagují pouze tehdy, mají-li přesně danou frekvenci – odtud název rezonance. Po skončení pulzů se jádra vracejí do původního směru a tento proces relaxace je snímán jako NMR signál.
Jev nukleární magnetické rezonance sloužil z počátku k analýze chemických látek. Dnes se pro toto použití v chemii používá název NMR spektroskopie. Zobrazování pomocí NMR (tedy MRI) se objevuje až po roce 1970. Slovo "nukleární" (čili jaderná) bylo v medicíně z názvu vypuštěno pro lepšího přijetí laickou veřejností.
Magnetický dipólový moment[upravit | editovat zdroj]
Atomové jádro se skládá z neutronů a protonů, které neustále rotují kolem své vlastní osy v pohybu nazývaném spin. Protony jsou kladně nabité částice a každá pohybující se nabitá částice vytváří magnetické pole a vykazuje magnetický moment. Magnetický moment, neboli také magnetický dipólový moment, je vektorová fyzikální veličina charakterizující magnetický dipól. Magnetický dipólový moment se značí m a jeho jednotkou je ampér metr čtverečný A.m2. Magnetický dipólový moment je určen vztahem m = IS, kde I je elektrický proud procházející smyčkou dipólu a S je orientovaná plocha ohraničená smyčkou dipólu. Pro konkrétní základní představu magnetického momentu uvažujme jen elektron. K jeho magnetickému momentu lze názorně dospět tímto způsobem: Budeme uvažovat nejjednodušší atom – atom vodíku, který je v klidu.
V elektrostatickém poli kladně nabitého jádra se bude záporně nabitý elektron pohybovat po uzavřených trajektoriích (orbitech). Elektron je elektricky nabitý, a proto vytvoří při uvažovaném pohybu po uzavřené trajektorii proudovou smyčku, která je ekvivalentní magnetickému dipólu. Tak vznikne magnetické pole, které je sice velmi slabé, ale přesto bude na elektron působit. Tímto způsobem lze dojít intuitivně k magnetickému momentu elektronu. U ostatních objektů (protony, jádra, atomy) je pak základní myšlenka výkladu magnetického momentu podobná. Veličina se jmenuje magnetický moment. Srovnáme-li tento pojem s mechanikou, nutně musíme dojít k závěru, že tato veličina bude popisovat rotující objekt. Vzhledem k tomu, že existuje veličina spin, která také v základním přiblížení souvisí s rotací, můžeme dospět k závěru, že i magnetický moment (elektronu, jádra, atomu) souvisí se spinem (elektronu, jádra, atomu).
Izotopy s sudým počtem protonů a sudým počtem neutronů mají jaderné spiny vykompenzované, a tím pádem nemají jaderný magnetický moment. Atomová jádra s lichým nukleonovým číslem si svůj magnetický moment zachovávají. Charakteristickým zástupcem této skupiny je atom vodíku 1H, který má jeden proton a vykazuje relativně velký magnetický moment. V organismu je více než 60 % vody a 1H je tedy nejvhodnějším objektem pro MR zobrazování. Další zástupci jsou 13C, 19F, 23Na, 31P.
Atomové jádro v magnetickém poli[upravit | editovat zdroj]
Vložíme-li jádro do silného magnetického pole, uspořádají se rotační osy protonů rovnoběžně se siločárami vnějšího magnetického pole. Větší počet z nich je v poloze, kdy jejich magnetický moment je orientován souhlasně (paralelně) s vektorem vnějšího magnetického pole a menší počet protonů je orientován opačně (o 180°, antiparalelně). Antiparalelní uspořádání protonů je energeticky náročnější, a proto je jich méně než polovina.
Princip NMR[upravit | editovat zdroj]
Princip NMR spočívá v tom, že je-li rotující jádro umístěno v konstantním magnetickém poli B0, dojde ke srovnání magnetických momentů (os rotace) s vnějším magnetickým polem a osa jádra bude lehce rotovat kolem směru působícího pole B0. Tento pohyb vzniká při každé změně působícího magnetického pole, dokud se jádro v dané poloze neustálí. Pokud vnější pole přestane působit, vrací se jádro do své původní klidové polohy. Pokud se přidá druhé kolmo působící (transverzální) pole BT, začne jádro opět rotovat. Aby byla jádra udržena ve stálém pohybu, používá se vysokofrekvenční magnetické pole, které současně rotuje v rovině XY. Volbou velikosti prvního statického magnetického pole B0 a volby velikosti pro transverzální magnetické pole BT se dá velice přesně určit, která jádra budou v rezonanci. Rezonancí je magnetický moment m jádra překlopen o 90° do roviny XY a osa pak rotuje podle transverzálního pole. Pokud je transverzální pole odpojeno, rotuje jádro stále v rovině XY. Přiblížením cívky do blízkosti rotujícího magnetického momentu se v ní indukuje napětí, které je následně měřeno. Zjednodušeně je velikost naměřeného napětí závislá na poloze a typu tkáně.
Larmorova frekvence[upravit | editovat zdroj]
Jak již bylo uvedeno, protony vykonávají rotační pohyb kolem své osy, neboli spin. Tím vytváří ve svém okolí magnetické pole a vykazují magnetický moment. Mimo to protony umístěné v magnetickém poli vykazují ještě pohyb precesní. Ten si lze představit jako pohyb po plášti pomyslného kužele (ještě názornějším příkladem nám může být pohyb káči). Frekvence tohoto pohybu se nazývá Larmorovou frekvencí. Ta závisí na dvou faktorech:
- na intenzitě vnějšího magnetického pole,
- na typu atomového jádra, vyjádřeném gyromagnetickým poměrem (konstanta závislá pouze na vlastnostech jádra).
- Příklad
Pro vodík 1H je gyromatický poměr = 42,58 MHz/T, tzn., že v poli B0 = 1,5 T budou mít vodíková jádra frekvenci precesního pohybu f0 64 MHz.
Rezonance[upravit | editovat zdroj]
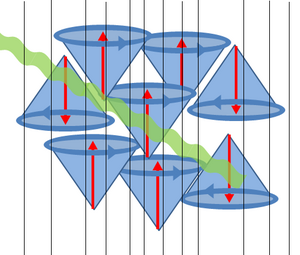
Jednak se směr magnetického momentu každého jednotlivého precedujícího protonu v čase mění a jednak se protony pohybují v různých fázích, neboli jsou nakloněny v daném čase různým směrem. Tím dochází ke vzájemnému vyrušení jejich vlivu na úhrnný vektor magnetizace tkáně v rovině kolmé na směr magnetického pole. Vektor výsledné tkáňové magnetizace má tedy směr totožný se směrem siločar vnějšího magnetu a v tomto stavu ho není možné měřit. Můžeme říci, že je v zákrytu vnějšího magnetického pole.
Abychom mohli měřit rezonanční frekvenci protonů, tedy jejich spektrum, je nutné vychýlit úhrnný vektor magnetizace z jeho rovnovážné polohy a tím docílit vzniku vektoru příčné tkáňové magnetizace. Jak bylo zmíněno výše, velikost příčného vektoru je nulová z důvodu chaotického pohybu částic. Změny lze dosáhnout dodáním energie v podobě elektromagnetického impulzu. Aby došlo k absorpci elektromagnetického vlnění protony, je potřeba, aby Larmorova frekvence částic byla shodná s frekvencí vyslaného impulsu.
Pokud tomu tak je, dochází k jevu magnetické rezonance, to má několik důsledků:
- protony začnou vykonávat svůj precesní pohyb ve fázi,
- dojde ke zmenšení rozdílu paralelně a antiparalelně (energeticky náročněji) uspořádaných protonů a tím se zmenší vektor podélné magnetizace.
Výsledkem je pak již zmíněný vektor příčné magnetizace.
„Situace bývá výstižně přirovnávána k výletní lodi s mnoha cestujícími na palubě: dokud jsou cestující rozmístěni a náhodně a celkem rovnoměrně po palubě, pluje loď rovně. Jakmile se však cestující shluknou dohromady začnou obcházet podél zábradlí palubu, bude se loď periodicky naklánět postupně na všechny strany.“
Relaxační časy T1 a T2[upravit | editovat zdroj]
Po skončení elektromagnetického impulsu již není protonům dodávána energie a proto se vrací do původního, energeticky výhodnějšího, paralelního postavení a mizí jejich synchronní pohyb. Tento děj se nazývá relaxace.
Dochází při něm k postupnému zvětšování podélného vektoru magnetizace a čas, za jaký dojde k obnovení tohoto vektoru na 63 % se označuje T1 (podélná relaxace, neboli spin-mřížka relaxace). Zároveň však dochází ke ztrátě vektoru příčné magnetizace vymizením synchronního pohybu protonů, což je důsledek vzájemného působení magnetických polí jednotlivých částic. Čas, za který klesne vektor příčné magnetizace na 37 % své hodnoty se označuje T2 (příčná relaxace, neboli spin-spin relaxace).
V absolutním měřítku jsou relaxační časy T1 2−10x delší než relaxační časy T2. V biologické tkáni se hodnoty T1 pohybují v rozmezí 300–2000 ms, T2 30–150 ms. V praxi je pokles příčné složky tkáňové magnetizace ovlivněn ještě drobnými změnami v nehomogenitě vnějšího magnetického pole. Pokles je tak podstatně strmější.
Typy elekromagnetických impulsů[upravit | editovat zdroj]
- Typy elektromagnetických pulsů, které se pro MR používají
- 90° puls – otáčející vektor tkáňové magnetizace o 90° a dochází ke vzniku vektoru příčného. Čas mezi jednotlivými pulsy se označuje TR (time to repeat). Čas TR mezi jednotlivými pulsy se zkracuje tak, aby tkáně po jeho skončení nestačily opět získat plnou hodnotu vektoru podélné magnetizace. Přijímaný signál z tkáně se pak liší tím, jak velký je vektor jejich tkáňové magnetizace v čase vyslání nového impulsu.
- kombinace 90° s 180° pulsu – 90° způsobí nárůst vektoru příčné magnetizace a po jeho skončení začne vektor opět klesat. Ovšem v čase označovaném TE/2 je vyslán 180° impuls, který o 180° změní orientaci precesního pohybu protonů a původně rychleji precedující protony jsou za protony precedujícími pomaleji a zmenšující se příčný vektor se začne zvětšovat. Za další dobu TE/2 dojde k synchronizaci pohybu protonů a výsledkem je opětovná maximalizace signálu. Po sečtení časů TE/2 získáme čas TE – čas ozvěny.
Magnetická pole[upravit | editovat zdroj]
Vnější magnetické pole MR magnetu je homogenní. V medicíně používané magnety vytvářejí pole obvykle v rozsahu 0,1–3 T. Pro výzkumné účely se však používají i pole o velikosti až 9,4 T, pro zvířata až 21 T. Jediné magnetické pole nám však neumožní získat prostorovou představu o jednotlivých protonech a s ní vytvořit scan pacienta. Aby však bylo možné odlišit signály vedené z různých vrstev těla, je potřeba, aby protony v různých místech reagovaly při zasažení elektromagnetickým vlnami o vhodné frekvenci.
Prostorové rozlišení a rekonstrukce obrazu MRI[upravit | editovat zdroj]
K homogennímu poli hlavního magnetu jsou proto přidána pole další. Pole, jehož intenzita roste s osou těla, vytváří tzv. magnetický gradient. Magnetický gradient s podélnou osou nám umožňuje zvolit rovinu řezu, a proto je nazýván „slice selecting gradient“ (rovinu řezu určující gradient). V praxi pak například u nohou působí pole o síle 0,45 T (odpovídající f= 19,160 MHz), kdežto u hlavy 0,55 T (f= 23,417 MHz). Vysláním vhodné frekvence vybíráme tedy jen řez, který chceme (Obr. 1).
Pro řez například oblouku aorty bude mít impuls frekvenci 22,566 MHz. Regulovat tloušťku řezu tedy můžeme dvěma způsoby:
- různým rozsahem frekvence impulsu, tedy čím větší rozsah pulsu, tím širší řez a vice versa,
- sklonem gradientu, jinak řečeno rozsahem pole, ve kterém se tělo nachází. Zde platí, že čím strmější je gradient (větší je rozdíl mezi silou pole u nohou a hlavy), tím užší řez získáme (Obr. 1).
Jelikož jedna souřadnice k prostorovému určení nestačí, je přidáno další pole. Tentokrát je ale pole na dlouhou osu těla kolmé, a síla se tedy mění v pravolevém směru. Díky tomu budou protony umístěné v různých „sloupcích“ těla emitovat různou frekvenci. Tento gradient je nazýván „frequency encoding gradient“ (frekvenci určující gradient) či „readout gradient“ (odečítací gradient) (Obr.3). Konečné určení bodu v prostoru poskytne třetí gradient, který však funguje poněkud odlišně. Nachází se opět v směru sloupců jako readout gradient, je však zapnut pouze na velice krátký okamžik před aplikací samotného readout gradientu. To ovlivní frekvenci precese jednotlivých protonů ve sloupci, avšak s ohledem na vzdálenost; tedy ty, které byly ovlivněny polem s vyšší intenzitou, budou mít vyšší frekvenci než zbylé. Jakmile tento gradient pomine, bude Larmorova frekvence protonů ve sloupci opět stejná, jenže už nebudou kmitat ve společné fázi, ale v různé podle toho, jak moc byly gradientem ovlivněny. Tento gradient je proto nazýván „phase encoding gradient“ (fázi určující gradient) (Obr. 2). Postup jednotlivých fází v jedné spin-echo frekvenci je znázorněn na obrázku (Obr. 4). Poté, co jsou získány echa frekvencí jednotlivých bodů v řezu, může být z k-prostoru pomocí Fourierovy 2D transformace vytvořen konečný obraz (Obr. 5).
Bohužel ani znalost toho, jak zařídit reakci přesně těch žádaných protonů, ještě neumožní získat scan, který by notně odpovídal představám vyšetřujícího lékaře. Všechny pulsy, které jsou aplikovány, nejen že musí být aplikovány, ale musí být aplikovány ve správnou chvíli. Na základě znalosti funkce T1, T2, TR a TE časů je možné získat velké množství různých obrazů. Vyšetřovacích metod, které se skládají z předem určeného pořadí funkcí, je nespočet, jejich základem však vždy bývají tři obrazy:
- PD obraz nese jméno podle zkratky Proton Density (protonová hustota). Na obrázku (Obr. 6) vidíme řez lebkou s jeho pomocí,
- druhý obraz je nazýván T1-vážený (Obr. 7) a je určen T1 časem jednotlivých tkání,
- poslední T2-vážený, jak už název napovídá, je určen T-2 časem tkání (Obr. 8).
- Příklady
Pro pole o síle 3T platí například hodnoty T1, T2:
- Šedá hmota mozková: 1200 ms, 80 ms.
- Bílá hmota mozková: 800 ms, 70ms.
- Mozkomíšní mok: 4000 ms, 600 ms.
- Arteriální krev: 1700 ms, 120 ms.
- Žilní krev: 1500 ms, 40 ms.
Situace, které mohou vzniknout, vypadají například takto:*
- Situace 1 odpovídá obrázku (Obr. 9)
- Situace 2 odpovídá obrázku (Obr. 10)
- Situace 3 odpovídá obrázku (Obr. 11)
- Situace 4 odpovídá obrázku (Obr. 12)
- Vysvětlivky k obrázkům
WM = bílá hmota mozková GM = šedá hmota mozková CSF= mozkomíšní mok Osa x: čas Osa y: síla signálu (T1 signál horní graf, T2 signál dolní graf)
Situace 1 odpovídá obrázku (Obr. 9)
T1: TR doba je už relativně krátká. Ačkoliv WM už kompletně zrelaxovalo a nevytváří žádný obraz, naproti tomu GM a CSF stále ještě nejsou zcela relaxované a obraz by vydávaly. Na čistě T1 obrazu by tak bylo možné pozorovat rozdíl mezi GM, CSF i prázdná místa (WM) T2: TE doba je dostatečně vysoká, aby zrelaxovala většina tkání v mozku na více než 37%. Díky tomu je rozdíl v síle signálu již dost vysoký, aby na čistě T2 obrazu mohly být pozorovány rozdíly v tkáních. Především výrazná je CSF. Celkový obraz: Ačkoliv oba obrazy samostatně vydávají solidní rozdíly mezi tkáněmi, jejich zrcadlovost způsobí, že po jejich složení, je výsledný relativní signál jednotlivých tkání téměř totožný, a na scanu tedy nejsou žádné struktury znát. Při kombinaci krátké TE a dlouhé TR tedy obraz nevznikne.
Situace 2 odpovídá obrázku (Obr. 10)
T1: TR doba je velmi dlouhá. Prakticky všechny tkáně za tuto dobu dokážou zrelaxovat. Rozdíl mezi T1 signálem WM a GM je v podstatě neměřitelný, CSF se drobně odlišuje a na samotném T1 obrázku by ho bylo možné slabě rozeznat. T2: TE čas je velmi krátký. Za tuto chvilku se ještě nestačily moc projevit rozdíly v tkáních. WM a GW by tedy vydávaly podobně silný signál, CSF téměř maximální. Celkový obraz: Kombinace velmi shodných signálů WM a GM v podstatě znemožňuje jejich výrazné rozeznání. Vyšší T2 signál je na úroveň WM a GM dorovnán nižším T1 signálem, a proto i celkový CSF signál je jen velmi nevýrazně odlišný. Takovýto scan s velmi krátkým TE a velmi dlouhým TR dává za vznik PD scanu.
Situace 3 odpovídá obrázku (Obr. 11)
T1: Relativně krátká TR doba neumožnila celkovou relaxaci tkání, a tak stále můžeme pozorovat odlišnosti v T1 signálu WM, GM i CSF. T2: Minimální TE téměř neumožňuje pozorovat odlišnosti tkání na základě T2. Celkový obraz: Výsledný scan v podstatě odpovídá čistě výsledkům T1 signálu, jelikož vliv T2 je minimální. Takovýto scan se proto nazývá T1- vážený obraz.
Situace 4 odpovídá obrázku (Obr. 12)
T1: Čas TR je velmi dlouhý. Za tuto dobu už téměř všechny tkáně zcela zrelaxovaly a jejich T1 signál je téměř neodlišitelný. T2: Dlouhá TE doba nám už dává možnost pozorovat odlišnosti v postupně relaxujících tkáních na základě T2 signálu. Obzvláště výrazně se projevuje u pomalu relaxujících tkání jako CSF. Celkový obraz: Protože zde naopak téměř nezasahuje T1 signál je celý obraz pod vlivem T2, tedy nazývá se T2-vážený.
Zobrazování MRI[upravit | editovat zdroj]
Obraz vzniká netriviálním zpracováním naměřených odpovědí na radiofrekvenční impulzy. To je výsledek závislý na neznámých parametrech, proto nelze uvažovat výsledný stupeň šedi v obraze jako absolutní číslo (podobně jako u Hounsfieldovy jednotky v CT), ale pouze relativně ve vztahu k stupňům šedi z okolních tkání. Dobře zobrazuje měkké tkáně. MRI nevyužívá ionizující záření, proto se považuje za bezpečnější a méně zatěžující než CT.
Jevu MRI lze dosáhnout dvojím způsobem:
- Můžeme pracovat s vnějším magnetickým polem o konstantní magnetické indukci B a hledat energii (|frekvenci) elektromagnetického vlnění schopnou vyvolat jadernou rezonanci
- Můžeme pracovat s konstantní energií (frekvencí) elektromagnetického vlnění a hledáme takovou hodnotu magnetické indukce B, při které dosáhneme rezonance – v tomto případě měníme hodnotu Larmorovy precese
Pokud se vyšetřovaná část těla nachází v homogenním magnetickém poli, pak radiofrekvenční impuls o patřičné energii vyvolá vznik NMR-signálu v celém objemu vyšetřované části těla a informace o lokálních hodnotách rezonance je ztracena. V nehomogenním magnetickém poli však můžeme vytvořit určitý gradient magnetické indukce B v určitém směru (například ve směru osy těla vyšetřovaného), čímž získáme stav, ve kterém je rezonanční podmínka splněna jen v úzkém řezu tělem vyšetřovaného kolmém na směr gradientu.
Nastavování těchto gradientů se děje v různých impulsových režimech a je rozdílné u různých variant MR i u různých typů přístrojů a speciálních aplikací. Tímto způsobem můžeme získat prostorově specifické informace o velikosti rezonančního signálu, který je úměrný počtu rezonančních jader v daném místě prostoru, tudíž jsme při použití Fourierovy transformace schopni získat i celkovou prostorovou informaci o rozložení rezonujících jader. Rozlišovací schopnosti MRI jsou závislé na jejich konstrukci, při použití supravodivých magnetů v prostředí kapalného helia jsme na základě chemických posunů schopni identifikovat i struktury látek přítomných v dané oblasti, provoz těchto zařízení je však velice nákladný.
Velkou výhodou MRI například oproti CT je, že jsme schopni získat řezy v různých rovinách – nejsme omezeni jen na řez příčný, ale můžeme získat i řez sagitální nebo frontální díky nastavení příslušného gradientu magnetické indukce B. Další výhodou je i fakt, že MRI nepoužívá ionizující záření, čímž je garantována i jistá neinvazivita pro buněčnou tkáň. Pro MRI rovněž mluví i fakt, že dosud nebyly pozorovány žádné účinky vystavení silným magnetům či radiofrekvečním impulsům na biologickou tkáň, proto je tato metoda vhodná i pro použití u dětí a v případě nutnosti i u těhotných. Fetální MRI se však provádí až po ukončení organogeneze (18. týden) kvůli zahřívání tkání radiofrekvenčním výbojem a možnosti ovlivnění vývoje embryonálních tkání.
Výhody[upravit | editovat zdroj]
- Přesnost zobrazení − na základě rozlišných intenzit signálu měkkých tkání (mozek, srdce, chrupavčitá tkáň...)
- Umožňuje rozlišit patologické stavy, které jsou jinak nezobrazitelné
- Neinvazivní metoda − nevyužívá škodlivého ionizujícího záření (vhodné i pro těhotné po 1. trimestru a novorozence)
- Informace o krevním oběhu, krevních cevách
- Některé angiografické snímky mohou být zobrazeny bez potřeby dodání kontrastní látky
- Funkční MRI umožňuje zobrazení obou aktivních části mozku při jednotlivých aktivitách
Kontrastní látky[upravit | editovat zdroj]
Používají se ke zlepšení obrazu – zviditelňují struktury, které nejsou v nativním obraze rozlišitelné. Principem jejich funkce je usnadnění relaxace protonů, čímž je zkrácena relaxační doba T1 a T2. Zkrácení relaxační doby T1 vede k zesílení T1 váženého obrazu, naopak u T2 vede k jeho zeslabení. Kontrastní látky lze rozdělit na látky paramagnetické a superparamagnetické.
Paramagnetické látky zesilují magnetické pole, a to způsobuje zkrácení relaxačního času okolí. Mnohdy obsahují gadolinium, které je pro člověka vysoce toxické, proto je vázáno ve formě chelátových komplexů. Mají široké využití, často se používají při vyšetření CNS, protože mohou pronikat poškozenou hematoencefalickou bariérou. Patří sem např. Magnevist (kyselina gadopentetová), Omniscan (gadodiamid), Dotarem (Gd-DOTA, kyselina gadoterová) a Mn-DPDP (mangafodipir, používá se k vyšetření jater). Superparamagnetické látky jsou pevné látky, které se do těla zavádějí formou suspenzí, mají mimořádnou účinnost. Příkladem jsou SPIO (superparamagnetic iron oxide) a USPIO (ultrasmall superparamagnetic iron oxide).
Zeemanův jev[upravit | editovat zdroj]
Jedná se o rozštěpení spektrálních čar atomu, na který působí vnější magnetické pole. Své pojmenování nese po holandském fyzikovi Pieteru Zeemanovi. Ten v roce 1897 jako první pozoroval štěpení spektrální čáry na triplet v slabém magnetickém poli, což je označováno jako normální Zeemanův jev. Většinou však dochází ke štěpení na více čar, tzv. anomální Zeemanův jev.
Energetické hladiny atomů ve vnějším magnetickém poli jsou kromě závislosti na hlavním kvantovém čísle závislé i na orbitálním a magnetickém kvantovém čísle, a také na magnetické indukci pole B.
Uvažujme atom vodíku bez hyperjemných struktur. Kvantové číslo mj nabývá 2j+1 možných hodnot. Ve vnějším magnetickém poli budou těmto stavům v důsledku různé orientace magnetických dipólů v magnetickém poli náležet různé energie. Z toho vyplývá, že každá energetická hladina se rozpadá na 2j+1 stejně od sebe vzdálených hladin, které jsou symetricky rozloženy okolo původní hladiny. Rozštěpení čar je větší pro silnější pole.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Principy diagnostických zobrazovacích metod
- Zobrazovací metody v neurochirurgii
- Speciální aplikace NMR
Použitá literatura[upravit | editovat zdroj]
- NAVRÁTIL, Leoš a Jozef ROSINA, et al. Medicínská biofyzika. 1. vydání. Praha : Grada, 2005. 524 s. ISBN 80-247-1152-4.
- ŽIŽKA, Jan a Vlastimil VÁLEK, et al. Moderní diagnostické metody. III. díl, Magnetická rezonance. 1. vydání. Brno : Institut pro další vzdělávání pracovníků ve zdravotnictví, 1996. ISBN 80-7013-225-6.
- CHLEBUS, P, M MIKL a M BRÁZDIL. Funkční magnetická rezonance – úvod do problematiky. Neurologie pro praxi [online]. 2005, roč. 6, vol. 3, s. 133-138, dostupné také z <http://fmri.mchmi.com/articles/chlebus_prehled.pdf>. ISSN 1213-1814.
- SEDLÁŘ, Martin, Erik STAFFA a Vojtěch MORNSTEIN, et al. Zobrazovací metody využívající neionizující záření [online]. Brno : Biofyzikální ústav Lékařské fakulty Masarykovy univerzity v Brně, 2013, dostupné také z <http://www.med.muni.cz/biofyz/zobrazovacimetody/files/zobrazovaci_metody.pdf>.
- HRAZDIRA, Ivo a Vojtěch MORNSTEIN. Lékařská biofyzika a přístrojová technika. 1. vydání. Brno : Neptun, 2001. 396 s. ISBN 80-902896-1-4.
- ROSINA, Jozef, Jana VRÁNOVÁ a Hana KOLÁŘOVÁ, et al. Biofyzika : Pro zdravotnické a biomedicínské obory. 1. vydání. Praha : Grada, 2013. 0 s. ISBN 978-80-247-4237-3.
Internetové zdroje[upravit | editovat zdroj]
- Autor neznámý, Princip MRI, http://fmri.mchmi.com/main_index.php?strana=13
- Autor neznámý, NMR, https://physics.mff.cuni.cz/vyuka/zfp/txt_410.pdf
- Autor neznámý, MRS, [1]
- Evžen Amler, Elektřina a magnetismus, https://moodle.mefanet.cz/login/index.php
- Jakub Nezval, NMR, http://artemis.osu.cz/biofyzika/Studium/Studmat/material/NMR.pptx
- Jitka Mazánková, Kontrastní látky a jejich nežádoucí účinky, https://is.muni.cz/th/326352/lf_b/Kontrastni_latky_a_jejich_nezadouci_ucinky.pdf
- Karla Miller, Manus Donahue, Rob Tijssen, Dan Bulte, Jamie Near, MRI Physics Course, FMRIB Centre – Department of Clinical Neurology, University of Oxford, https://www.win.ox.ac.uk//education/graduate-training-course/program/lectures/mri-physics/mri-physics-course
- Miloš Vojtíšek, RF cívka pro MR systém, https://www.vutbr.cz/www_base/zav_prace_soubor_verejne.php?file_id=40375
- Viktor Babjak, Zeemanov jav, https://www.viktorbabjak.cz/domains/viktorbabjak.cz/public/documents/practical/prak4-17-zeemanov-jav.pdf
Obrázky[upravit | editovat zdroj]
- Obrázky 1–5, zdroj: VÁLEK, Vlastimil a Jan ŽIŽKA. Moderní diagnostické medoty. III. díl, Magnetická rezonance. 1. vydání. Brno : Institut pro další vzdělávání pracovníků ve zdravotnictví, 1996. ISBN 8070132256.
- Obrázky 6–12, zdroj: Manus Donahue, Contrast Manipulation, FMRIB Centre – Department of Clinical Neurology, University of Oxford